Arricchimento di target oncologici nel campo della biopsia liquida

Fino a circa una decina di anni fa, il gold standard per la caratterizzazione molecolare dei tumori era la biopsia di tessuto. Ciò significava che, sia per la diagnosi che per il monitoraggio della malattia, era necessario effettuare un’operazione chirurgica spesso invasiva. Recentemente, un nuovo approccio ha fatto enormi passi avanti e ha costituito una vera e propria rivoluzione nel campo dell’oncologia di precisione. La tecnica di cui stiamo parlando è la biopsia liquida. Essa è un metodo non invasivo che permette l’analisi molecolare di campioni biologici di natura liquida. Il campione che viene più diffusamente analizzato è il sangue, in quanto esso entra in contatto con la maggior parte dei tipi di tumore, ma anche fluidi biologici come le urine, il fluido cerebrospinale, il liquido ascitico e pleurico vengono sempre più utilizzati e caratterizzati.
Questa tecnica permette l’isolamento di diversi tipi di componenti derivanti dal tumore, come le cellule tumorali circolanti (CTC), che possono derivare sia dal tumore primario che dalle metastasi, il DNA e l’RNA tumorali circolanti (ctDNA, ctRNA), ovvero acidi nucleici liberamente circolanti derivanti da tumore, e le vescicole extracellulari derivanti da tumore (tdEVs).
I vantaggi della biopsia liquida rispetto a quella tissutale sono innumerevoli, dalla bassa invasività della tecnica, all’analisi genomica, trascrittomica, epigenomica e proteomica di questi elementi che sono in grado di fornire informazioni preziose riguardanti l’evoluzione del tumore. In aggiunta, la biopsia liquida è molto più veloce e consente una sensibilità di analisi maggiore ad un costo inferiore. Infine, il monitoraggio continuativo dell’evoluzione della malattia permette una valutazione in tempo reale della risposta alle terapie. La Figura 1 riassume il tipo di analiti rilevabili, di analisi effettuabili e di informazioni ricavabili tramite biopsia liquida e le conseguenti applicazioni cliniche.
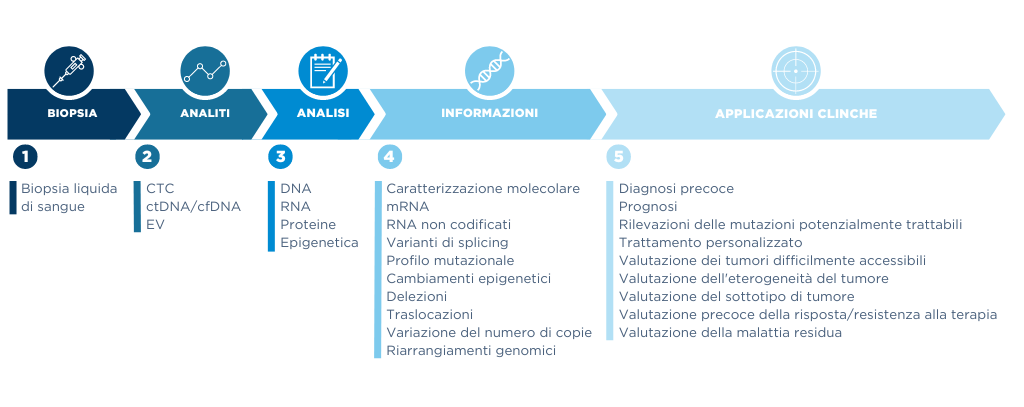
In questo ambito, la divisione Life Sciences di ALTEN ITALIA si è inserita nell’ambizioso progetto di ricerca a sostegno di un’importante multinazionale. Data l’importanza clinica sia delle CTC che delle EV, il progetto di R&D è stato volto allo sviluppo di un flusso sperimentale che permettesse l’isolamento e analisi molecolare di entrambe le componenti a partire dallo stesso campione di sangue intero. Per raggiungere l’obiettivo ci si è focalizzati sulla glicoproteina di membrana EpCAM – Epithelial cell adhesion molecule. Il marcatore in questione è il biomarker di elezione per catturare le CTC di origine epiteliale derivanti da tumori metastatizzanti come quello al seno, alla prostata e al colon-retto. Inoltre, l’EpCAM è stato recentemente utilizzato anche per la cattura di tdEVs. Un team multidisciplinare affiatato, una tecnologia vincente, passione per la biologia e tanta determinazione sono stati gli ingredienti per portare a casa il risultato.
CTC e tdEV: chi sono e come si catturano
Le CTC sono cellule che si distaccano dal tumore primario e si spostano tramite il sistema circolatorio andando a causare l’insorgenza di metastasi, dette anche tumori secondari. Sono considerate essere cellule rare in quanto si ha una CTC ogni milione di leucociti. Il loro numero è variabile ed è correlato alle condizioni del tumore: è stato infatti dimostrato che minore è il loro numero e maggiore è il tasso di sopravvivenza. Nel campo della biopsia liquida, le tecniche di isolamento delle CTC sono molteplici. Quella più utilizzata prevede l’arricchimento positivo delle CTC tramite il legame selettivo tra cellula e un anticorpo specifico, il quale può essere immobilizzato su una superficie di un dispositivo o su un magnete.
Le vescicole extracellulari (EV) sono particelle delimitate da un doppio strato lipidico che vengono secrete dalle cellule e rilevate in vari fluidi biologici, come il plasma, le urine, il fluido cerebrospinale e la saliva, svolgendo un ruolo fondamentale nella comunicazione cellula-cellula. Esse vengono rilasciate nel sangue in grande quantità dalle cellule tumorali prendendo il nome di tumor-derived extracellular vesicles (tdEV). Recentemente, molti studi hanno dimostrato che esse ricoprono un ruolo importante nel promuovere la crescita e la sopravvivenza cellulare, nel modellare il microambiente tumorale e nell’aumentare l’invasività e attività metastatica. Anche i metodi per isolare le EV sono molteplici e, come per le CTC, ne includono la cattura anche tramite arricchimento immunomagnetico. Nonostante gli innumerevoli passi avanti, esistono molti fattori che ancora limitano l’utilizzo delle EV in campo clinico, come ad esempio l’efficienza di isolamento.
Biopsia liquida: Lo sviluppo del kit
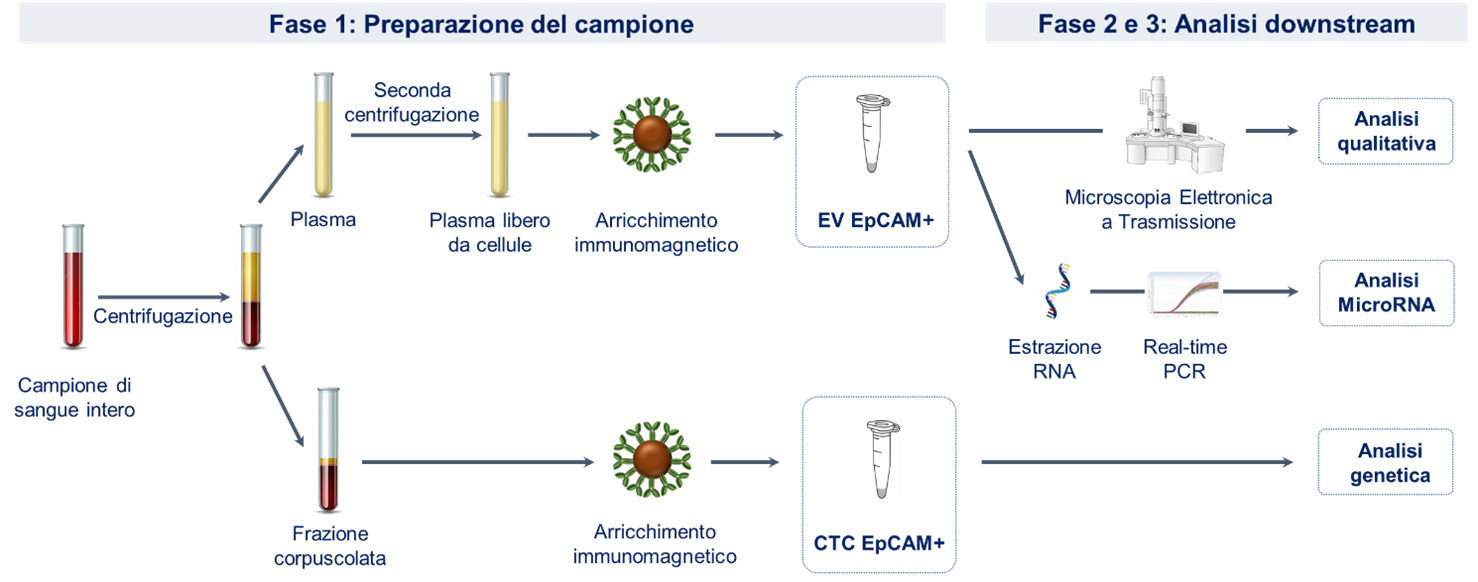
ALTEN Life Sciences ha affiancato il team R&D del cliente per sviluppare un’applicazione aggiuntiva in un kit IVD (In Vitro Diagnostic) già presente sul mercato. L’uso previsto del kit è la selezione delle CTC a partire dalla frazione corpuscolata del sangue per la successiva analisi genetica. La tecnologia di arricchimento utilizza nanoparticelle immunomagnetiche funzionalizzate con anticorpi anti-EpCAM. Il progetto è quindi consistito nell’inserimento di uno step aggiuntivo per l’arricchimento, utilizzando la stessa tecnologia, delle vescicole EpCAM+ a partire dalla frazione di plasma dello stesso campione di sangue (Figura 2, fase 1). Due risorse di ALTEN ITALIA altamente specializzate in ambito biofarmaceutico hanno supportato il gruppo R&D del cliente nella fase di concept development del progetto, che comportava una serie di test sperimentali per valutarne la fattibilità. Le consulenti Life Sciences hanno collaborato nell’ideazione, pianificazione, esecuzione degli esperimenti, analisi e presentazione dei dati. Inoltre, hanno avuto anche la responsabilità della produzione della documentazione del progetto in accordo al processo del Design control e alla normativa di qualità ISO 13485. Diverse sono state le sfide sperimentali da affrontare, per la cui risoluzione il team di ALTEN è stato fondamentale grazie all’apporto di competenze tecniche e teoriche di biologia cellulare e molecolare.
Di seguito sono elencati le fasi e i relativi step del flusso sperimentale che sono stati ottimizzati:
La prima fase è stata la preparazione del campione arricchito di EV:
- Un primo step è stato quello dell’ottenimento di un plasma libero da cellule del sangue. L’obiettivo è stato realizzato grazie a numerosi test di centrifugazione del plasma e di conta dei diversi tipi di cellule residue al fine di valutare la velocità di centrifugazione più idonea per eliminarle.
- Il secondo step è consistito nell’adattamento del protocollo di selezione delle CTC all’arricchimento delle EV a partire dalla frazione di plasma.
seconda fase è stata quella della verifica dell’avvenuto arricchimento delle vescicole nel campione, che ha comportato il test di diversi metodi di visualizzazione. Tra questi, la microscopia elettronica a trasmissione (TEM) ha dato i risultati più promettenti consentendo non solo la visualizzazione delle EV ma anche l’analisi di parametri qualitativi come la dimensione e la morfologia.
Una terza ed ultima fase è consistita nell’ottimizzazione di un flusso di lavoro per l’analisi, tramite Real-Time PCR, dei MicroRNA contenuti nelle vescicole. I MicroRNA sono corti frammenti di RNA non codificante a singolo filamento attivi nella regolazione dell’espressione genica a livello trascrizionale e post-trascrizionale. Essi possono agire sia da oncogéni che da oncosoppressori, ovvero rispettivamente favorendo o bloccando lo sviluppo del tumore.
Questa fase ha visto l’ottimizzazione di 5 diversi step:
- Estrazione dell’RNA dal campione di vescicole
- Concentrazione dell’RNA
- Retrotrascrizione a cDNA
- Pre-amplificazione del cDNA
- Real Time PCR
Lo schema del flusso sperimentale è riassunto per intero in Figura 2.
Una volta terminati gli esperimenti, i risultati sono stati approvati dalla commissione di portfolio management, la quale, entusiasta del lavoro svolto, ha richiesto la sottomissione di un abstract a congressi internazionali e l’avvio della fase di fattibilità del progetto. La fase iniziale di “concept development” è stata così completata con successo e i risultati ottenuti sono stati presentati, riscuotendo molto interesse, al meeting annuale 2023 dell’American Association for Cancer Research.
Articolo a cura di M. Masotti





